Actualmente, el mundo está atravesando por la denominada segunda ola en el marco de la pandemia del coronavirus, la cual ha dejado cifras más catastróficas, si se compara con el primer ciclo, en Europa y Estados Unidos. Chile no está ajeno a esta situación y, por estos días, ya se comienzan a ver los primeros efectos.
Ante esto, las esperanzas para acabar con esta crisis sanitaria y volver a la anhelada normalidad han estado puestas en las vacunas. Muchas de ellas han sido aprobadas en diversos países y los procesos ya han comenzado.
No obstante, y en dirección opuesta, poco se ha hablado sobre posibles antídotos que se puedan crear contra el SARS-CoV-2, básicamente pensando en personas que están en grupos de riesgo (enfermos, adultos mayores, embarazadas) y les es riesgosa la inoculación.
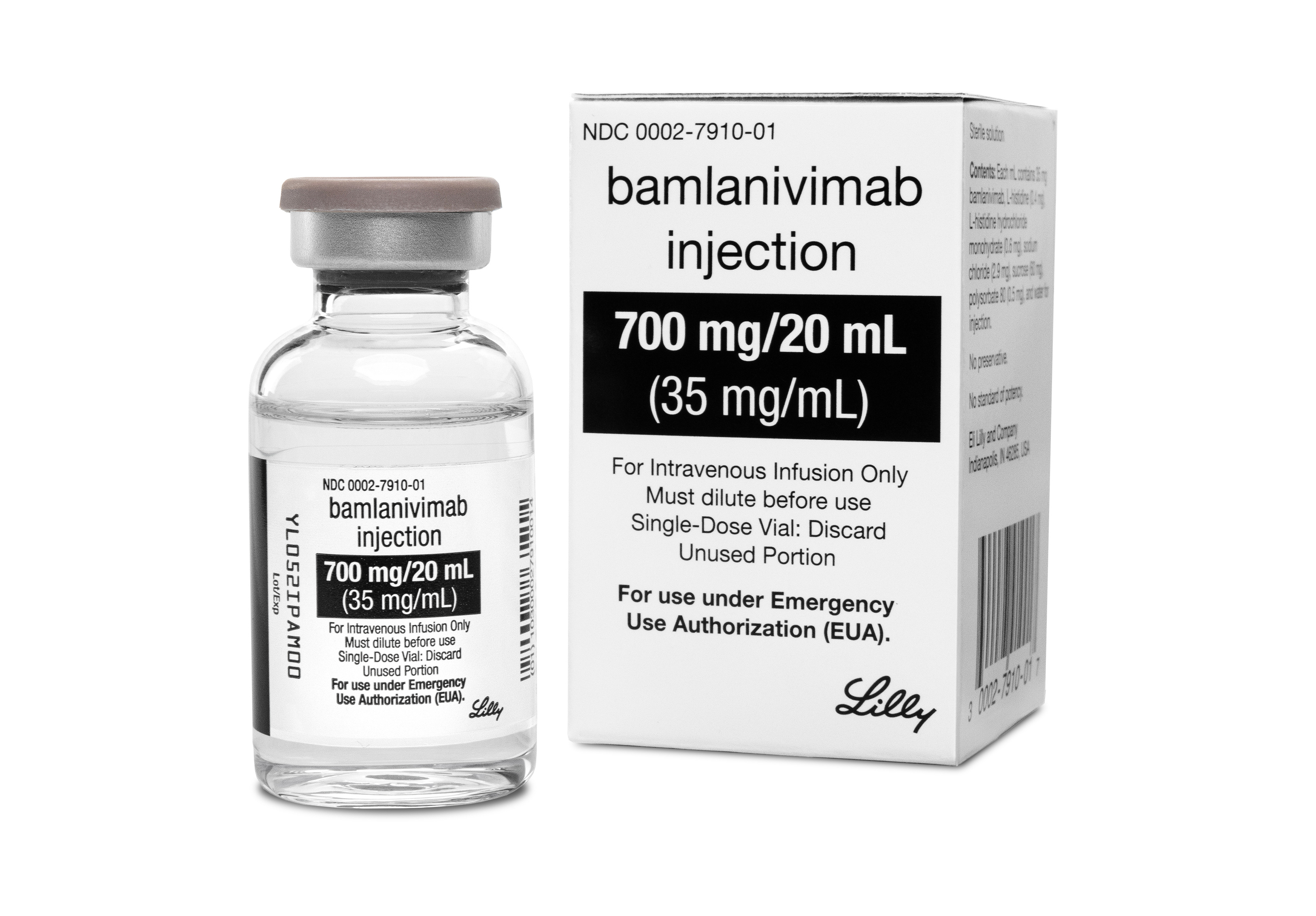
Hace algunas semanas, la Agencia Reguladora de Medicamentos Norteamericana (FDA) aprobó el uso de emergencia del primer medicamente exclusivo contra el coronavirus, el cual recibe el nombre de Bamlanivimab y consistiría en un método innovador.
Este producto precisamente fue autorizado para el uso de dosis bajas en pacientes adultos y pediátricos (infantes) que no hayan sido hospitalizados.
Según detalla la BBC, este medicamente está basado en anticuerpos monoclonales (producidos por un solo clon de linfocitos B) y estaría pensado para permitir que el enfermo tenga una respuesta positiva ante el virus, cuando la infección no es del todo grave.
Para recabar más antecedentes, BioBioChile se contactó con dos expertos chilenos que pudieron explicar cómo es el funcionamiento de este tratamiento, el cual tiene como objetivo neutralizar la proteína Spike del virus SARS-CoV-2.
En este sentido el médico José Gregorio Martínez, infectólogo de Clínica Vespucio, sostuvo que el Bamlanivimab se suministra pór la vía endovenosa, a través de una inyección.
Por ahora, en Estados Unidos sólo pueden optar a este tratamiento experimental las personas que tengan más de 12 años y pesen más de 40 kilogramos. Asimismo, las dosis de adultos son de 700 mg.
“Es un anticuerpo monoclonal, no es un medicamento nuevo porque existen muchos de este tipo de anticuerpos, el cual se creó en el laboratorio a través de unas células que las hacen ‘inmortales’ y la única función de ellas es producir los anticuerpos del tipo IgG 1, el cual está diseñado para unirse a la proteína Spike del coronavirus”, indicó.
“De esa manera, bloquea la unión del receptor en la célula, y de esa manera evita una posible infección”, añadió.
Por otro lado, Martínez también sostiene que de momento la utilización de este fármaco es experimental en casos puntuales, hasta determinar posibles contraindicaciones.
“De acuerdo a la información oficial, la seguridad de este medicamento aún no se conoce totalmente. Actualmente hay registrados cinco ensayos clínicos, de los cuales tres están recolectando pacientes. Es muy poca información la que se tiene sobre el Bamlanivimab para estar seguros. Es por eso que la FDA la aprueba y recomienda en el contexto de protocolos de información”, señaló.
“No obstante, se recomienda no utilizarlo en pacientes que ya están hospitalizados por COVID-19 o que tengan aumento de los requerimientos de oxígeno, porque la aprobación de este medicamento fue para enfermedad leve a moderada”, añadió.
En este sentido el doctor Michel Serri, infectólogo de Clínica Dávila, realizó una diferencia entre los estudios de tratamientos y los que se han realizado a vacunas.
“Las fases de estudio no son las mismas que en vacunas. En los fármacos se investiga, se evalúan pacientes jóvenes y luego vienen las pruebas con placebos para ver la efectividad versus no hacer nada. Ahí se demuestra una efectividad concreta”, comentó.
“Actualmente hay sólo dos trabajos, uno que fue hecho en personas ambulatorias, que eran cuadros leves, el cual evidenció su efectividad para evitar la progresión de la enfermedad”, señala Serri.
Asimismo, Martínez también sostuvo que uno de los objetivos claves de este antídoto es ayudar a bajar la cifra de personas hospitalizadas o sometidas a ventilación artificial.
“Con la urgencia de encontrar un tratamiento y antídoto, apenas empiecen a rastrear algunos datos positivos van a aprobar su uso en pacientes de manera más regular. Sin embargo, el tiempo formal para que un medicamento entre en vigor son entre uno y dos años”, concluyó.
“Lo que está haciendo la FDA en la actualidad es diseñar los lineamientos de un protocolo, por ejemplo limitar sus usos en mayores de 65 años o enfermos crónicos”, añadió Serri.
AFP