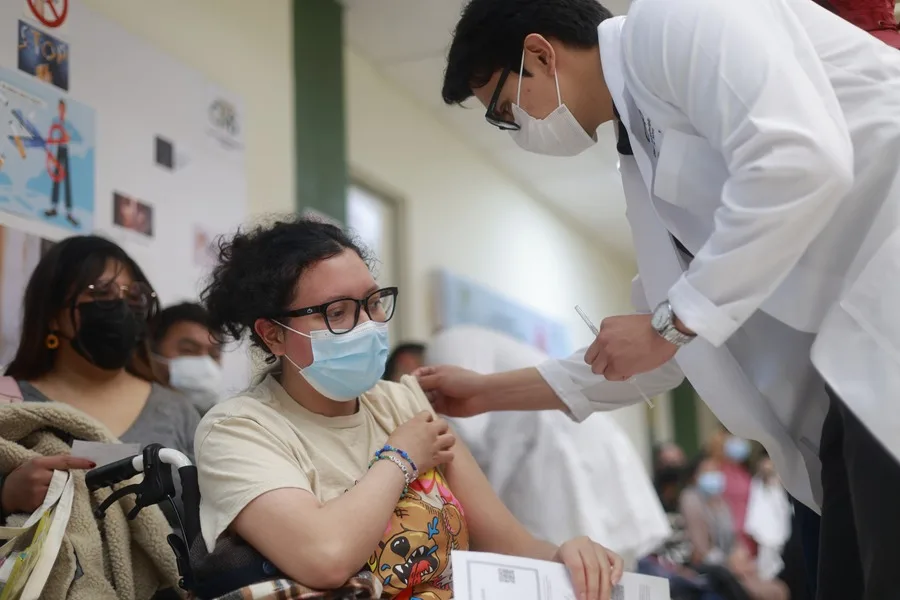
México vivió en abril de 2009 una de sus más grandes crisis en materia de salud pública debido a la pandemia del virus de la influenza AH1N1
Este documento resume los eventos claves de la pandemia de la influenza H1N1 2009 y las actividades de respuesta de los CDC para fines históricos. Este documento es un resumen; no es un informe completo de todas las acciones y actividades de los CDC ni pretende representar los esfuerzos de respuesta de otras agencias y entidades asociadas.
Preparación para la pandemia, antecedentes
La pandemia de la influenza (gripe) H1N1 2009 ocurrió como trasfondo de la planificación de la respuesta a la pandemia en todos los niveles del gobierno, incluyendo años de desarrollo, perfeccionamiento y ejercitación de los planes de respuesta a nivel internacional, federal, estatal, local y comunitario. En ese momento, los expertos consideraron que los virus de la influenza aviar A (H5N1) representaban la mayor amenaza de pandemia. Los virus de la influenza H5N1 eran endémicos en las aves de corral en algunas partes del mundo e infectaban esporádicamente a las personas, a veces con resultados devastadores. Dada esa realidad, los esfuerzos de preparación para la pandemia se basaban ampliamente en un escenario de enfermedades humanas graves causadas por el virus de la influenza H5N1. Más allá de las diferencias en los escenarios de planificación y la pandemia de influenza H1N1 2009 en sí, muchos de los sistemas establecidos a través de la planificación fueron utilizados y útiles para la respuesta ante la pandemia de influenza H1N1 2009.
La respuesta de los CDC ante la pandemia de influenza H1N1 2009 fue compleja, multifacética y a largo plazo; duró más de un año. El fin de este documento es el de informar al público sobre los eventos claves de la pandemia que se produjeron y la respuesta de los CDC. A continuación, encontrará una descripción resumida de los eventos relacionados con los CDC en cuanto a la pandemia de influenza H1N1 2009.
Surge un virus
La influenza H1N1 2009 se detectó por primera vez en los EE. UU. en abril de 2009. Este virus fue una combinación única de genes de virus de la influenza nunca antes identificados en animales o humanos. Los genes del virus fueron una combinación de genes estrechamente relacionados con los virus de la influenza porcina H1N1 de la línea de América del Norte y los virus de la influenza porcina H1N1 de la línea de Eurasia. Debido a esto, los reportes iniciales hicieron referencia al virus como virus de influenza de origen porcino. Sin embargo, las investigaciones de casos iniciales en humanos no identificaron exposición a cerdos y rápidamente se llegó a la conclusión de que este nuevo virus estaba circulando entre humanos, no entre piaras de cerdos de EE. UU.
La infección por este nuevo virus de influenza A (en ese momento llamado «virus de influenza A de origen porcino») se detectó por primera vez en un paciente de California de 10 años el 15 de abril de 2009, a quien le realizaron pruebas para detectar la influenza como parte de un estudio clínico. Las pruebas de laboratorio realizadas por los CDC confirmaron que este virus era nuevo en los humanos. Dos días después, las pruebas de laboratorio de los CDC confirmaron una segunda infección con el virus en otro paciente de 8 años, proveniente de California, a casi 130 millas de distancia del primer paciente que se examinó como parte de un proyecto de vigilancia de la influenza. No hubo conexión alguna entre los dos pacientes. Los análisis de laboratorio de los CDC determinaron que los virus obtenidos de estos dos pacientes eran similares, y distintos de cualquier otro virus de la influenza anteriormente analizados en humanos o animales. Las pruebas demostraron que estos dos virus eran resistentes a los dos medicamentos antivirales, amantadina y rimantadina, pero susceptibles a los medicamentos antivirales oseltamivir y zanamivir. Los CDC iniciaron una investigación inmediata sobre la situación junto con funcionarios locales y estatales de la salud animal y humana de California.
Los casos de influenza H1N1 2009 en California ocurrieron en el contexto de informes esporádicos de infecciones humanas por el virus de la influenza porcina de la línea de América del Norte en los EE. UU., mayormente relacionados con el contacto cercano con cerdos infectados. (Durante diciembre de 2005 a enero de 2009, se informaron 12 casos de influenza porcina en humanos; cinco de estos 12 casos se produjeron en pacientes que tuvieron exposición directa a cerdos, seis pacientes reportaron haber estado cerca de cerdos y una de las fuentes de contagio de uno de los casos no se determinó). Se han documentado muy pocos casos de virus de influenza porcina diseminados de persona a persona y se desconoce que hayan resultado en brotes entre personas en comunidades. A mediados de abril de 2009, sin embargo, la detección de dos pacientes infectados con el virus de la influenza de origen porcino a 130 millas de distancia causó preocupación sobre un nuevo virus de influenza de origen porcino que logró introducirse entre la población humana y comenzó a a diseminarse.
Los CDC se mantuvieron en estrecho contacto con las comunidades internacionales de salud mientras se producía el brote y el 18 de abril de 2009, bajo las Regulaciones Sanitarias Internacionales (IHR, por sus siglas en inglés) el Programa de Regulaciones Internacionales de Salud de los EE. UU. informó sobre los casos de influenza H1N1 2009 a la Organización Mundial de la Salud (OMS, por sus siglas en inglés). Los casos también se informaron a la Organización Panamericana de la Salud (OPS), Canadá y México, como parte de la Sociedad para la Seguridad y Prosperidad de América del Norte.
Aumentan las respuestas
Los CDC trabajaron estrechamente con funcionarios locales y estatales de la salud animal y humana sobre investigaciones epidemiológicas a través del rastreo del contacto de los dos pacientes para tratar de determinar la fuente de contagio y el análisis de la relación entre los pacientes y los cerdos. Además, se llevó a cabo la vigilancia para tratar de detectar casos adicionales de humanos infectados con el virus. En base a la ubicación geográfica de los primeros casos, la falta de contacto entre ellos y la influenza porcina y los datos recopilados a través del contacto de pruebas de laboratorio, los epidemiólogos de los CDC llegaron a la conclusión de que el contagio del virus había ocurrido de humano a humano. En un artículo titulado Dos niños infectados con la influenza porcina tipo A (H1N1) — Sur de California, marzo-abril de 2009 publicado el 21 de abril de 2009 en el Informe semanal de morbilidad y mortalidad (MMWR)los CDC describieron los casos y solicitaron que los laboratorios de salud pública del estado les enviasen las muestras de influenza A que no hayan sido clasificadas en subtipos. El mismo día, los CDC respondieron las consultas de los medios de comunicación relacionados con los MMWR de informes médicos. En un día, se identificaron tres muestras adicionales de este nuevo virus en los hospitales del Condado de San Diego y el Condado de Imperial, California y fueron enviados a los CDC para pruebas posteriores. La prueba de laboratorio de los CDC confirmó que estas muestras también dieron positivo para el virus que luego se denominaría «H1N1 2009».
Al 21 de abril de 2009, los CDC habían comenzado a trabajar para desarrollar un virus que se pudiese utilizar para fabricar una vacuna contra este nuevo virus (denominado virus candidato para la vacuna). Hay muchos pasos a seguir para producir una vacuna,- el primer paso es obtener un rendimiento alto del virus de la vacuna. Un alto rendimiento del virus de la vacuna es una muestra del virus que se utiliza para cultivar el virus en grandes cantidades en huevos de pollo. Una vez que el virus crece en grandes cantidades, las partículas del virus se purifican para fabricar la vacuna. Teniendo en cuenta que el virus H1N1 2009 era un virus nuevo, y que, como todos los virus de la influenza es impredecible, los CDC simultáneamente realizaban múltiples métodos científicos para crear un virus de alto rendimiento. Un virus aislado en los CDC, (denominado A/California/07/2009) fue seleccionado para ser el virus que se utilizaría para fabricar la vacuna. Los CDC enviaron el virus de la vacuna a las compañías fabricantes de vacunas para que pudiesen comenzar con la producción de la vacuna, en caso de que el gobierno de los EE. UU. decidiese que era necesario hacerlo.
Los CDC pusieron en marcha el Centro de Operaciones de Emergencia (EOC, por sus siglas en inglés) el 22 de abril de 2009 para coordinar la respuesta a esta emergente amenaza a la salud pública. Las actividades de respuesta fueron organizadas en estructuras de grupo según el Sistema Nacional de Manejo de Incidentes (NIMS, por sus siglas en inglés)Estos grupos pertenecían a distintas áreas de interés pero no se limitaban a: vigilancia, asuntos de laboratorio, comunicaciones, poblaciones con riesgos, medicamentos antivirales, vacunas y asuntos relacionados con la salud de los pasajeros. A medida que se producía el brote, las estructuras de grupo y el personal eran asignados periódicamente para funcionalidad y utilidad.
El 23 de abril de 2009, muestras enviadas por Texas revelaron dos casos adicionales de infecciones humanas por influenza H1N1 2009, lo que transformó la investigación en una respuesta ante un brote en varios estados. Al mismo tiempo, los CDC habían examinado 14 muestras de México, algunas de las cuales habían sido recolectadas de pacientes que habían estado enfermos antes que los primeros 2 pacientes de EE. UU. (California). Siete resultados de las muestras dieron positivo para la influenza H1N1 2009 y se informó acerca de resultados similares para muestras presentadas por México a Canadá. Estaba claro que ocurrieron casos en varios países y la diseminación de persona a persona del virus parecía ser constante. Ese mismo día, los CDC dieron la primera rueda de prensa formal para informar a los medios de comunicación y guiar la respuesta pública y a los cuidados de salud sobre la situación que evolucionaba rápidamente. Los CDC brindaron casi 60 ruedas de prensa durante la respuesta de la influenza H1N1 2009.
El 24 de abril de 2009, los CDC cargaron secuencias completas de genes del virus de la influenza H1N1 2009 a bases de datos accesibles al público a nivel internacional, lo que permitió que científicos alrededor del mundo utilizasen las secuencias para realizar investigaciones de salud pública y compararlas con los virus de la influenza recolectados en otros lugares. Se publicó un informe actualizado del brote por Internet en el MMWR.
El mundo de prepara para una posible pandemia
El sábado 25 de abril de 2009, bajo el reglamento de las regulaciones internacionales de salud, el Director General de la OMS declaró al brote de la influenza H1N1 2009 una emergencia de salud pública de preocupación internacional y recomendó que los países intensificaran la vigilancia por brotes pocos comunes de enfermedades similares a la influenza y neumonía grave. Además, el 25 de abril de 2009, funcionarios de la ciudad de Nueva York informaron sobre una investigación dentro de un grupo de enfermedades similares a la influenza en un colegio secundario y las pruebas de los CDC confirmaron dos casos de infección por el virus de la influenza H1N1 2009 en Kansas y otro caso en Ohio inmediatamente después.
El 26 de abril de 2009, el gobierno de los EE. UU. determinó que existía una emergencia de salud pública a nivel nacional; la Reserva Estratégica Nacional (SNS, por sus siglas en inglés) de los CDC comenzó a entregar el 25% de los suministros que podían utilizarse para proteger y tratar la influenza. Esto incluyó 11 millones de regímenes de medicamentos antivirales, y equipos de protección personal, incluyendo más de 39 millones de dispositivos para protección respiratoria (mascarillas comunes y de respiración), batas, guantes y visores, a los estados (las asignaciones estuvieron basadas en la población de cada estado).
Como parte de los esfuerzos nacionales previos de planificación para una pandemia, al 2009 de abril, el Gobierno Federal compró 50 millones de tratamientos de medicamentos antivirales, oseltamivir y zanamivir, para la SNS y los estados compraron 23 millones de regímenes antivirales. Luego de la determinación de emergencia en el sector de la salud pública, la FDA también decidió actuar para expandir el uso de los medicamentos antivirales oseltamivir y zanamivir a través de la Autorización del Uso de Emergencia (EUA, por sus siglas en inglés)
Las EUA permitía el uso de productos de un modo diferente que el aprobado por la FDA. Esto incluía el uso dentro y fuera de etiqueta de:
oseltamivir para tratar a niños menores de 1 años y ayudar a prevenir la influenza en niños de 3 meses a 1 año y oseltamivir y zanamivir para tratar pacientes con síntomas por más de dos días antes del inicio del tratamiento, o quienes han padecido enfermedades complicadas que requieren de hospitalización.
El 27 de abril, el Director General de la OMS intensificó el nivel de alerta por una pandemia de influenza de la fase 3 a la fase 4, basándose principalmente en información epidemiológica que mostró casos de contagio entre humanos y la capacidad del virus de causar brotes en las comunidades. Basándose en informes de enfermedades generalizadas similares a la influenza y numerosas enfermedades graves y muertes en México, los CDC publicaron advertencias de salud para los viajes en las que se recomendó a los estadounidenses que pospusieran los viajes a México que no fuesen necesarios. Como en temporadas anteriores de influenza, los CDC instaron a la población, especialmente a quienes tienen mayor riesgo de sufrir complicaciones relacionadas con la influenza a protegerse tomando medicamentos antivirales en los comienzos de la enfermedad cuando el médico lo indicare; además, los CDC aconsejaron que todas las personas tomasen medidas de prevención diarias, como cubrirse la boca y nariz al toser y estornudar y permanecer en sus casas y no concurrir al trabajo ni a la escuela cuando se está enfermo para ayudar a disminuir la propagación de la enfermedad.
El 29 de abril de 2009, la OMS elevó el alerta de pandemia de influenza de la fase 4 a la fase 5, indicó que una pandemia era eminente y solicitó que todos los países activasen inmediatamente sus planes de preparación para la pandemia y estuviesen alertas a los brotes poco comunes de enfermedades similares a la influenza y neumonía grave. El gobierno de los EE. UU. ya estaba implementando su plan de respuesta ante la pandemia. Los CDC continuaron publicando y actualizando la guía para los estados, las clínicas, los laboratorios, las escuelas, los socios y el público sobre temas que abarcaban las medidas no farmacéuticas que podían tomar las comunidades para limitar la propagación de la enfermedad, cómo evaluar a los pacientes con probables infecciones de influenza H1N1 2009 y cómo cuidar de los niños que pudieran enfermarse de influenza H1N1 2009.
El 30 de abril de 2009, los CDC publicaron un informe MMWR describiendo el brote inicial de influenza H1N1 2009 en México. Los resultados en México indicaron que la propagación de la enfermedad allí implicaba un contagio entre personas de múltiples generaciones. Los CDC también publicaron un informe de MMWR sobre el brote de influenza H1N1 2009 en una escuela secundaria de la ciudad de Nueva York, que fue, en ese momento, el grupo portador más grande informado de los casos de influenza H1N1 2009 en los EE. UU.El informe sugirió que los estudiantes de la escuela secundaria tenían síntomas respiratorios y de fiebre similares a los causados por la influenza estacional, pero además, alrededor de la mitad tenía diarrea, que es más de lo esperado para la influenza estacional. A medida que se conocían más los detalles del brote, la respuesta federal continuaba a toda marcha. Además, el 30 de abril de 2009, el HHS anunció que el Gobierno Federal compraría 13 millones adicionales de dosis de medicamentos para tratamientos antivirales destinados a combatir la influenza. Los tratamientos adicionales serían incluidos a la Reserva Estratégica Nacional (SNS, por sus siglas en inglés).
Debido a que el brote comenzó a expandirse, los CDC comenzaron a recibir informes sobre el cierre de escuelas y la implementación de medidas de distanciamiento social a nivel comunitario para desacelerar la diseminación de la enfermedad. Autoridades de escuelas y funcionarios de salud pública seguían con sus planes para la pandemia y haciendo todo lo que podían para atenuar la propagación de la enfermedad. (Las medidas de distanciamiento social sirven para aumentar la distancia entre las personas. Las medidas incluyen permanecer en el hogar en caso de estar enfermo excepto para buscar atención médica, evitar grandes reuniones sociales, teletrabajo e implementar el cierre de escuelas).
Los laboratorios de los CDC refuerzan la capacidad de prueba del país
Mientras se realizaban esfuerzos para desarrollar una vacuna segura y efectiva para proteger a las personas de la influenza H1N1 2009, los CDC también trabajaban para ayudar a los laboratorios que apoyaban a los profesionales de los cuidados de salud para identificar más rápido las muestras del virus de la influenza H1N1 2009 de pacientes. La prueba PCR en tiempo real desarrollada por los CDC contaba con la autorización para ser utilizada por los laboratorios de diagnóstico de la FDA según la autorización de uso de emergencia (EUA) el 28 de abril de 2009, menos de dos semanas después de que se identificó al nuevo virus pandémico. Antes de la disponibilidad de esta autorización de uso de emergencia (EUA), los laboratorios de salud pública pudieron determinar si los virus de la influenza A se trataban de virus de influenza estacional o de una nueva cepa, y gracias a los nuevos kits de diagnóstico los laboratorios pudieron confirmar que se trataba del virus H1N1 2009. El 1 de mayo de 2009, los kits de diagnóstico de los CDC comenzaron a ser enviados a laboratorios de salud pública nacional e internacional. (Cada kit de diagnóstico contenía reactivos para poner a prueba 1,000 muestras clínicas). Desde el 1 mayo hasta el 1 de septiembre de 2009, más de 1,000 kits fueron enviados a 120 laboratorios nacionales y a 250 laboratorios internacionales en 140 países. Una vez que los laboratorios recibieron los kits de prueba y verificaron que las pruebas funcionaban adecuadamente, pudieron identificar nuevos casos con una mayor rapidez a lo acostumbrado y ya no se necesitaba más enviar muestras a los laboratorios de los CDC para obtener la confirmación. Aunque la transición de las pruebas fuera de los laboratorios de los CDC no fue de la noche a la mañana, entre el 23 de abril y el 31 de mayo de 2009, los laboratorios de influenza de los CDC analizaron cerca de 5,000 muestras de virus de influenza, cinco veces el número que se procesó en un marco de tiempo similar durante el 2008 y más que durante cualquier temporada anterior de influenza. Al 18 de mayo de 2009, 40 estados estaban autorizados para llevar a cabo sus propias pruebas para la influenza H1N1 2009, con ocho estados que contaban con múltiples laboratorios para realizar las pruebas. Los CDC alertaron al público que la expansión de la capacidad de las pruebas podían resultar en un incremento en la cantidad de casos de influenza H1N1 2009, pero que esto mostraría una realidad más precisa del verdadero alcance de la influenza H1N1 2009 en los EE. UU.
Al 1 de mayo de 2009, los CDC habían logrado determinar algunos puntos interesantes sobre el virus de la influenza H1N1 2009.
Investigadores habían confirmado al comienzo de las pruebas que el virus de la influenza H1N1 2009 era un virus reordenado cuádruple, lo que implica que contiene genes del virus que se originó de cuatro fuentes diferentes del virus de la influenza. Algunos de los segmentos del virus se originaron a partir del virus de influenza porcina en América del Norte, algunos de ellos se originaron a partir del virus de influenza aviar en América del Norte, un segmento se originó de un virus humano de influenza y dos segmentos fueron de los que generalmente se encuentran en los virus comunes de la influenza porcina en Asia y Europa.
Las pruebas de varias muestras del virus enviadas a los CDC demostraron tener una gran similitud, lo que implica que se originaron de la misma fuente.
Las pruebas de laboratorio arrojaron que el virus de la influenza H1N1 2009 no contaba con ninguno de los marcadores de 1918 que habían estado asociados a un alto riesgo de enfermedad grave.
Las pruebas no encontraron marcadores genéticos previamente asociados con las tasas de muertes en las personas infectadas con el virus de la influenza aviar A (H5N1) en otros países.
El 4 de mayo de 2009, los CDC dejaron de proporcionar informes sólo sobre casos confirmados de influenza H1N1 2009 y comenzaron a informar casos confirmados y posibles de influenza H1N1 2009. Hasta ese momento, más de un 98% de «posibles» virus de la influenza daban positivo para la influenza H1N1 2009, lo que indica que la escala del brote va en aumento. Casos probables de influenza fueron informados a los CDC por departamentos de salud estatal y tuvieron lugar en personas cuyas pruebas dieron positivo para la influenza A y negativo para los subtipos de influenza estacional A(H1N1) y A(H3N2) en sus laboratorios de los departamentos de salud estatal, pero cuyas muestras no habían sido sometidas a pruebas de confirmación para el virus de la influenza H1N1 2009.
Los CDC comparten personal, pautas y primeros resultados de estudios
Los CDC emplearon un gran número de personas en el campo para respaldar la respuesta ante el brote; para el 1 de mayo de 2009, se emplearon 50 personas, y ese número aumentó a más de 100 para el 11 de mayo de 2009, antes de descender gradualmente a medida que los equipos de campo regresaron del despliegue para completar los estudios, analizar los datos recopilados y colaborar con información en la toma de decisiones en cuanto políticas para la intervención y control de la influenza H1N1 2009. En el transcurso del brote, más de 3,300 personas de los CDC apoyarían la respuesta.
El 6 de mayo de 2009, los CDC distribuyeron recomendaciones para el uso de medicamentos antivirales para la influenza a fin de ofrecer pautas para los médicos a la hora de recetar medicamentos antivirales para el tratamiento y la prevención (quimioprofilaxis) de la influenza H1N1 2009. Los CDC recomendaron que se prioricen las pruebas y los tratamientos antivirales para personas con enfermedades respiratorias graves y personas con alto riesgo de sufrir complicaciones por la influenza estacional. Esto incluía niños menores de 5 años, embarazadas, personas con afecciones médicas crónicas y personas de 65 años en adelante.
El 8 de mayo de 2009, los CDC emitieron un MMWR con información actualizada sobre la situación en México, Estados Unidos y en todo el mundo, y el 15 de mayo de 2009, los CDC publicaron Salud para viajes La recomendación de advertencia de no hacer viajes que no sean esenciales a México, vigente desde el 27 de abril de 2009, fue reducida a precaución de salud para viajes a México.
Para este punto del brote, cerca de la mitad de todos los virus de influenza que se detectaron a través de vigilancia en el laboratorio eran virus H1N1 2009, y la otra mitad eran virus de influenza estacional comunes, incluyendo la influenza estacional A H1N1, influenza A H3N2 y virus tipo B. Los informes de vigilancia indicaron que el mayor número de casos de influenza H1N1 2009 confirmados y probables (alrededor del 57% de los casos) se producían entre personas de 5 a 24 años, y el 41% de las hospitalizaciones se producían entre niños mayores y adultos jóvenes. Las tasas de hospitalización más altas se produjeron entre niños menores de 5 años; la siguiente tasa de hospitalización más alta fue en personas de 5 a 24 años. En base a los datos de pandemias de influenza anteriores y sobre la influenza estacional, las embarazadas han sido reconocidas como un grupo de alto riesgo en el brote. La información temprana sobre la enfermedad de la influenza H1N1 2009 entre embarazadas fue comunicada en un artículo publicado en un informe de MMWR el 12 de mayo de 2009. Este artículo hacía énfasis en la importancia del tratamiento empírico (tratamiento sin pruebas confirmatorias) de embarazadas que se sospechaba tenían influenza H1N1 2009. Las personas con otras afecciones médicas previamente reconocidas que las ponían en mayor riesgo de sufrir complicaciones por la influenza estacional al parecer también estaban en mayor riesgo de sufrir las complicaciones por la influenza H1N1 2009. En este informe, el setenta y un por ciento (71%) de los pacientes hospitalizados tenían una o más afecciones médicas crónicas subyacentes. Las muertes reportadas se produjeron en personas de entre 22 meses y 57 años. Asimismo, sólo el 13% de hospitalizaciones se produjo en personas de 50 años en adelante, y hubo pocos casos y ninguna muerte en personas mayores de 65 años, lo cual fue inusual comparado con la influenza estacional.
Los primeros resultados de un estudio sobre anticuerpos conducido por los CDC indicó que los niños no tenían anticuerpos interreactivos al virus de la influenza H1N1 2009, mientras que cerca de un tercio de los adultos mayores de 60 años tenían anticuerpos interreactivos contra el virus de la influenza H1N1 2009. Una posible explicación de este anticuerpo preexistente en adultos mayores fue que pueden haber tenido una exposición previa, ya sea a través de la infección o la vacunación, a un virus de influenza A H1N1 que estaba relacionado en forma más cercana al virus de la influenza H1N1 2009 de lo que están los virus de la influenza estacional A (H1N1) contemporáneos. La información de un estudio similar sugirió que la vacuna contra la influenza estacional no proporcionaría ninguna protección significativa contra los virus de la influenza H1N1 2009.
Se declara el estado de pandemia
El 11 de junio de 2009, la OMS señaló que se estaba desarrollando una pandemia global de influenza H1N1 2009 al aumentar aún más el nivel de alerta de pandemia a nivel mundial a Fase 6. Ese día, los CDC brindaron su primera conferencia de prensa con el nuevo director de los CDC Thomas Frieden, MD, MPH. La conferencia de prensa tuvo un total de 2,355 participantes. En ese momento, más de 70 países habían reportado casos de infección por el virus H1N1 2009, y brotes a nivel comunitario de H1N1 2009 estaban produciéndose en múltiples partes del mundo. La decisión de la OMS de elevar el nivel de alerta de pandemia a la Fase 6 fue un reflejo de la diseminación del virus en otras partes del mundo y no un reflejo de cambios en el virus de la influenza H1N1 2009 o en la enfermedad asociada. Hasta la fecha, la mayoría de personas en los Estados Unidos que habían contraído el virus de la influenza H1N1 2009 no se enfermaron gravemente y se recuperaron sin hospitalización.
Después de la declaración de pandemia de la OMS el 11 de junio, el virus H1N1 2009 continuó diseminándose y el número de países que informaban casos H1N1 2009 casi se duplicó desde mediados de junio de 2009 hasta principios de julio de 2009. Los niveles de la enfermedad producida por el virus H1N1 2009 continuaron siendo significativos, con brotes localizados y en algunos casos de actividad intensa. Para el 19 de junio de 2009, los 50 estados en los Estados Unidos, el Distrito de Columbia, Puerto Rico, y las Islas Vírgenes de EE. UU. informaron casos de infección por el virus H1N1 2009. Los Estados Unidos continuaron informando el mayor número de casos de H1N1 2009 comparado con cualquier país del mundo, a pesar de que la mayoría de las personas que se enfermaron se recuperaron sin necesidad de tratamiento médico. Para finales de junio, más de 30 campamentos de verano en los EE. UU. habían informado brotes de la enfermedad producida por el virus H1N1 2009, y los CDC emitieron una guía para campamentos residenciales y diurnos para reducir la propagación de la influenza. En la Reunión del Comité Asesor sobre Prácticas de Inmunización del 25 de junio de 2009 , los CDC estimaron que al menos 1 millones de casos de influenza H1N1 2009 se habían producido en los Estados Unidos.
A principios de julio de 2009, se detectaron tres virus de influenza H1N1 2009 que eran resistentes al medicamento antiviral oseltamivir en tres países. (Se denomina resistencia antiviral cuando un virus cambia de tal manera que el medicamento antiviral es menos efectivo para tratar o prevenir la enfermedad causada por el virus). Los socios de los CDC y la OMS siguieron vigilando la resistencia antiviral, a pesar de que se continuaron detectando casos muy aislados de resistencia antiviral.
También en julio de 2009, los CDC informaron hallazgos en el MMWR que indicaban una notable prevalencia de obesidad en pacientes de cuidados intensivos con casos confirmados de influenza H1N1 2009. Durante la pandemia, los CDC continuarían examinando la relación entre la influenza H1N1 2009, la obesidad, las enfermedades graves y otros factores de riesgo subyacentes.
Los CDC continuaron trabajando con el Consejo de Epidemiólogos Estatales y Territoriales (CSTE, por sus siglas en inglés) para mejorar la vigilancia de la influenza H1N1 2009. Debido a que los casos de H1N1 2009 continuaron produciéndose durante la primavera y el verano, la tarea de contar los casos se hizo cada vez más difícil. El 12 de mayo de 2009, los CDC pasaron de informar el número de casos de influenza H1N1 2009 probables y confirmados a informar la suma total de casos de influenza H1N1 2009 probables y confirmados en el laboratorio, hospitalizaciones y muertes con el lanzamiento de un sitio web de informe global. Una vez que la cantidad de casos aumentó más allá del punto en el que contar los casos individuales era práctico, el 23 de julio de 2009, los CDC informaron la cantidad de 2009 casos por última vez. La presentación de informes de hospitalizaciones y muertes por influenza H1N1 2009 continuó. Además, los CDC continuaron usando sus sistemas tradicionales de vigilancia para rastrear el progreso del brote de influenza H1N1 2009. Los sistemas tradicionales de vigilancia no cuentan casos individuales, en cambio monitorea niveles de actividad y características del virus a través de un sistema nacional de vigilancia.
Los CDC trabajaron estrechamente con los países del hemisferio sur para monitorear y mejorar la vigilancia de los virus de influenza durante los meses de verano. La temporada de influenza del hemisferio norte comenzó el 2009 y los países allí informaron que el virus H1N1 2009 se estaba diseminando y provocando enfermedad junto con los virus comunes de influenza estacional. Después de mediados de julio, la actividad de la enfermedad en la mayoría de los países disminuyó, y para noviembre, las regiones templadas del hemisferio sur informaron un nivel muy bajo de actividad de la influenza H1N1 2009. En general, la experiencia del hemisferio sur con el virus H1N1 2009 fue similar a lo que habitualmente se ve durante una temporada regular de influenza y no pareció impactar excesivamente en los sistemas de cuidados de salud en el hemisferio sur. Además, los sistemas de vigilancia no detectaron cambios significativos en los virus H1N1 2009 que estaban circulando en el hemisferio sur en comparación con los virus aislados de personas en el hemisferio norte. Estos hallazgos proporcionaron a los EE. UU. indicios valiosos en cuanto a lo que podría ser la temporada de influenza 2009-2010 en los Estados Unidos. Más importante aún, la ausencia de cambios significativos en el virus indicó que la vacuna contra la influenza H1N1 2009 que se estaba fabricando sería efectiva contra los virus H1N1 2009 que están actualmente en circulación, y probablemente proporcionarán a las personas una buena protección contra la influenza H1N1 2009.
Observación continua y respuesta
La actividad del virus de la influenza H1N1 2009 en el verano alcanzó su punto máximo en los Estados Unidos durante mayo y junio y descendió durante julio y principios de agosto. Sin embargo, los niveles de actividad de la influenza permanecerían por encima de lo normal durante todos los meses del verano con brotes localizados. Durante las dos últimas semanas de agosto, la actividad de la influenza H1N1 2009 comenzó a incrementarse nuevamente en los Estados Unidos.
En agosto de 2009, los CDC informaron otros casos de infecciones con virus resistentes al oseltamivir en dos pacientes inmunosuprimidos en Seattle, Washington. Luego, a mediados de septiembre, los CDC informaron dos casos adicionales de influenza H1N1 2009 resistente al oseltamivir en dos campistas de verano en Carolina del Norte. Los CDC y sus socios continuaron rastreando de cerca la resistencia antiviral de la influenza H1N1 2009. A partir de junio de 2010, el virus H1N1 2009 permanece susceptible a los medicamentos antivirales oseltamivir y zanamivir, con pocas excepciones. Los casos de resistencia antiviral son rastreados detenidamente y las cifras actualizadas se publican cada semana como parte de la publicación de los CDC FluView.
A finales de agosto, los CDC comenzaron a trabajar con la cadena de sumisistros comerciales (fabricantes, distribuidores, minoristas) en ciertas medidas paliativas contra la influenza para monitorear semanalmente los niveles de sumisistros críticos (antivirales y equipos de protección respiratoria) en el inventario nacional. Esta visibilidad proporcionó información importante para guiar la toma de decisiones SNS que llevaron a la divulgación de medidas paliativas adicionales.
La FDA y el fabricante del medicamento antiviral Tamiflu® (oseltamivir) reconocieron que los suministros comerciales y almacenados de Tamiflu® suspensión oral (formula líquida para niños) eran limitados en octubre de 2009. Los CDC trabajaron con sus socios para llegar a los farmacéuticos con información general, actualizaciones sobre suministros de medicamentos antivirales e instrucciones sobre cómo elaborar suspensiones orales a partir de cápsulas de Tamiflu® para adultos (la combinación consiste en la mezcla de medicamentos por un profesional de cuidados de salud para cubrir las necesidades exclusivas de un paciente). Los CDC también proporcionaron instrucciones para padres y cuidadores sobre cómo hacer una mezcla de medicamentos para niños usando cápsulas de Tamiflu® y un líquido espeso y dulce. Los CDC también analizaron información de vigilancia relacionada y, en base al analisis, se distribuyeron 500,000 botellas de suspensión oral pediátrica de parte de la SNS de los CDC para compensar una falta de producción y satisfacer la creciente demanda de la fórmula.
El 23 de octubre de 2009, la FDA emitió una autorización de uso de emergencia (EUA) para el Peramivir IV. El Peramivir IV es un medicamento antiviral intravenoso en etapa de investigación que se utiliza para tratar a las personas que han sido hospitalizadas a causa de una influenza grave. Este medicamento fue conservado en la Reserva Nacional Estratégica (SNS, por sus siglas en inglés) y distribuido por los CDC bajo una autorización de uso de emergencia (EUA). Los profesionales clínicos con licencia podían solicitar este producto a través del sistema electrónico de solicitud del sitio web de los CDC, y el producto era enviado directamente a las instalaciones del hospital. También en octubre, el HHS autorizó la entrega de 59.5 millones de mascarillas de respiración N95 adicionales.
Los CDC cerraron los informes de hospitalizaciones y muertes a causa de la influenza H1N1 2009 para la temporada 2008-09 a finales de agosto. El 30 de agosto de 2009, se implementaron modificaciones en los informes para permitir que los estados reporten hospitalizaciones y muertes asociadas a cualquier tipo de influenza o para que reporten hospitalizaciones y muertes usando una definición de caso sindrómico de neumonía e influenza a través de los informes de actividad total de hospitalizaciones y muertes. (AHDRA). Este cambio en los informes fue implementado a fin de proporcionar un panorama más completo de los inconvenientes ocasionados por la influenza grave y las muertes durante la pandemia. La nueva temporada de informes para la temporada de influenza 2009-2010 comenzó el 30 de agosto de 2009, y las primeras cifras nuevas para la temporada 2009-2010 fueron reportadas en el ejemplar del 11 de septiembre de 2009 de FluView.
Durante el curso de la pandemia, los CDC perfeccionaron y modificaron sus métodos de vigilancia, y finalmente desarrollaron una metodología basada en la información de vigilancia para estimar el rango de casos, hospitalizaciones y muertes por influenza H1N1 2009 en los Estados Unidos. Los CDC divulgaron sus primeras estimaciones oficiales de casos, hospitalizaciones y muertes por influenza H1N1 2009 el 12 de noviembre de 2009, y las actualizaron el 10 de diciembre de 2009, 15 de enero de 2010, 12 de febrero de 2010, 12 de marzo de 2010, 19 de abril de 2010 y por última vez el 14 de mayo de 2010.
Vacunación contra la influenza H1N1 2009
La aparición y la diseminación del virus H1N1 2009 causó un nivel de actividad extraordinario de enfermedades similares a la influenza en Estados Unidos durante el verano y los meses de otoño de 2009. Durante este período, la actividad de la influenza alcanzó su nivel más alto en el informe semanal del 24 de octubre de 2009, donde 49 de 50 estados informaron una diseminación generalizada a nivel geográfico. Un pilar muy importante de la respuesta del gobierno de los EE. UU. a la pandemia de la influenza H1N1 2009 fue el lanzamiento de la campaña nacional de vacunación contra la influenza H1N1 2009 que comenzó en octubre.
El lanzamiento de la campaña de vacunación estuvo guiado por mucha actividad.
Desde principios de junio de 2009, se realizaron llamadas semanales para brindar actualizaciones relacionadas con la vacuna a los planificadores locales y estatales, y el 8 de julio de 2009, los CDC publicaron una guía para los departamentos de salud pública locales y estatales para ayudarlos a planificar la campaña de vacunación contra la influenza H1N1 2009. El 9 de julio de 2009, el Departamento de Salud y Servicios Humanos, el Departamento de Seguridad Nacional, el Departamento de Educación y la Casa Blanca organizaron una reunión cumbre sobre la preparación para la influenza para que los funcionarios federales, estatales, locales y tribales discutieran las planificaciones para la pandemia, las lecciones aprendidas y las prioridades de preparación. En la reunión cumbre, el Gobierno Federal anunció la disponibilidad de $350 millones en financiación suplementaria para que utilicen los departamentos de salud estatales, locales y territoriales para reforzar sus actividades de respuesta ante la pandemia de influenza H1N1 2009 y alentó firmemente a los socios estatales, tribales y locales a prepararse para comenzar un programa de inmunización contra la influenza H1N1 2009 para mediados de octubre de 2009.
La Reunión Cumbre Nacional de Vacunación contra la Influenza 2009, una sociedad de miembros públicos y privados comprometidos para el logro del objetivo de personas saludables 2010 con la vacunación contra la influenza, se realizó el 29 de junio. Durante la reunión cumbre 2009, los participantes recibieron actualizaciones de expertos en varios campos profesionales, incluyendo medicina privada, salud pública, comunicación de la salud, fabricación de vacunas, distribución de vacunas y políticas relacionadas con las vacunas. Los CDC han sido copatrocinadores de este evento, junto con la Asociación Médica Estadounidense desde 2001.
Durante la preparación para el programa de inmunización contra la influenza H1N1 2009, el 22 de julio de 2009, los Institutos Nacionales de la Salud (NIH) anunciaron el comienzo de una serie de ensayos clínicos para experimentar lotes pilotos de dos versiones de vacunas contra la influenza H1N1 2009 de distintos fabricantes en personas sanas, además de personas con afecciones subyacentes como asma y VIH. Los resultados preliminares de los ensayos clínicos se anunciaron públicamente.
El 23 de julio de 2009, el Comité Asesor sobre Vacunas y Productos Biológicos Relacionados de la FDA apoyó el plan propuesto por la FDA para otorgar la licencia para vacunas monovalentes contra la influenza H1N1 2009 por medio de un «cambio de cepas», de manera similar a cómo se otorgan las licencias para las vacunas contra la influenza estacional. Esto significaba que la vacuna contra la influenza 1N1 2009 se haría de la misma manera utilizando los mismos estándares que ya se utilizaban para las vacunas de temporada. También permitió otorgar licencias para proceder más rápidamente ya que no se requerían los datos de inmunogenia ni datos adicionales de seguridad (excepto para las vacunas atenuadas en virus vivos) para otorgar las mismas.
El 29 de julio de 2009, el Comité Asesor sobre Prácticas de Inmunización (ACIP, por sus siglas en inglés) se reunió para realizar recomendaciones para la vacuna contra la influenza H1N1 2009. El ACIP recomendó que la mayor cantidad de personas posible recibiera la vacuna contra la influenza H1N1 2009 a la brevedad. Los suministros limitados inicialmente de la vacuna H1N1 2009 contra la influenza fueron destinados a ciertos grupos de personas, en base a datos epidemiológicos y virológicos que indicaban que tenían un mayor riesgo de contagio o de padecer complicaciones graves a causa de la influenza. Se calculó que los grupos iniciales prioritarios para la vacunación estaban conformados por casi 159 millones de personas que incluían: embarazadas, personas que viven con bebés o cuidan a bebés menores de 6 meses, personal de servicios médicos de emergencia y de cuidados de salud, bebés de 6 meses a adultos jóvenes de 24 años y adultos de 25 a 64 años que tienen un alto riesgo de padecer complicaciones por la influenza H1N1 2009 debido a trastornos de salud crónicos o sistemas inmunitarios comprometidos. El ACIP también recomendó que los profesionales de los cuidados de salud y las autoridades de salud pública locales tengan la flexibilidad para determinar a nivel local cuán rápido y cuándo extender la vacunación a otros grupos ya que la disponibilidad y la demanda de las vacunas podrían variar según el área.
Los CDC organizaron tres reuniones de compromiso público a mediados de agosto en diez regiones de los Estados Unidos con el propósito de solicitar la participación de los ciudadanos en la planificación para la vacunación. El público brindó su opinión a los CDC con respecto a cómo se debería proporcionar la vacuna en los Estados Unidos, y la información recolectada sirvió para informar cómo se distribuyó la vacuna contra la influenza H1N1 2009 luego de ser fabricada. En última instancia, se decidió que la vacuna debía distribuirse tan pronto como estuviera lista para que las personas estuvieran protegidas contra la influenza a la brevedad, en lugar de esperar hasta que se prepararan grandes cantidades para distribuir la vacuna.
A fines de agosto, los CDC publicaron un estudio en el MMWR que resumía una investigación de los casos confirmados en laboratorio de influenza H1N1 2009 identificados del 24 de abril al 25 de julio de 2009 en Chicago, Illinois. El estudio descubrió que la tasa de morbilidad general fue más alta entre los niños de 5-14 años (147 cada 100,000 personas), que fue 14 veces más alta que en adultos mayores de 60 años. Un total de 205 (13%) pacientes fueron hospitalizados y se observó la tasa más alta entre niños de 0 a 4 años (25 cada 100,000), seguida de niños de entre 5 y14 años (11 cada 100,000). Estos hallazgos también aportaron información para las estrategias de vacunación.
Para fines de agosto de 2009, se habían desarrollado vacunas prototipos para prevenir el contagio del virus H1N1 2009 pero todavía no se les había otorgado la licencia. Se estaban desarrollando enormes cantidades de vacunas necesarias para proteger a toda la población de los Estados Unidos. Los CDC extendieron su contrato para el programa infantil Vacunas para Niños en los Estados Unidos (McKesson Specialty Distribution) para ofrecer una distribución centralizada de la vacuna contra la influenza H1N1 2009. Se asignaron suministros disponibles de vacunas a los estados en base a su población total y se enviaron a los centros de vacunación privados y públicos según los pedidos hechos por los estados. Se solicitó a los proveedores participantes que firmaran un acuerdo de proveedores para asegurar que cumplieran con los requerimientos del estado para la administración de la vacuna.
El 3 de septiembre de 2009, los CDC publicaron en el MMWR un estudio que había analizado los datos relacionados con las muertes de niños a causa de la influenza H1N1 2009 informadas a los CDC de abril a agosto de 2009.. Los datos mostraron que a partir del 8 de agosto de 2009, se informaron a los CDC 477 muertes confirmadas en laboratorio a causa de influenza H1N1 2009 en los Estados Unidos, entre las que se incluyen 36 niños menores de 18 años. El sesenta y siete por ciento (67%) de los niños que murieron por influenza H1N1 2009 padecían por lo menos una afección médica de alto riesgo. Los CDC continuaron instando a los padres a detectar tempranamente la influenza H1N1 2009 en los niños y buscar atención médica cuando fuera necesaria. Los CDC también reiteraron que todos los niños de 6 meses o mayores y los cuidadores de niños menores de 6 meses debían recibir la vacuna contra la influenza H1N1 2009 cuando estuviera disponible.
El 10 de septiembre de 2009, la Secretaria del HHS y el Director de los CDC participaron junto con la Fundación Nacional para Enfermedades Infecciosas (NFID, siglas en inglés) de una conferencia de prensa para resaltar la vigilancia de la influenza estacional durante una temporada inusual e instaron a los estadounidenses a vacunarse tempranamente contra la influenza estacional. Además de la NFID, el HHS y los CDC, la conferencia de prensa se organizó en colaboración con la Asociación Médica Estadounidense (AMA, por sus siglas en inglés), la Academia Estadounidense de Pediatría (AAP), el Colegio de Médicos de EE. UU. (ACP), la AARP y la reunión cumbre nacional sobre la vacunación contra la influenza.
El 15 de septiembre de 2009, la Administración de Alimentos y Medicamentos (FDA) anunció la aprobación de cuatro vacunas contra la influenza H1N1 2009, y posteriormente, el 16 de noviembre, anunció la aprobación de la quinta vacuna contra la influenza H1N1 2009 para protegerse del virus de la influenza H1N1 2009.
Los NIH anunciaron el 21 de septiembre de 2009, que los primeros resultados de los ensayos clínicos la vacuna contra la influenza H1N1 2009 en niños parecían promisorios. Los análisis preliminares indicaban que las vacunas eran seguras, y que sólo una dosis de la vacuna contra la influenza H1N1 2009 era necesaria para generar una respuesta inmunológica para que la mayoría de las personas de 10 a 17 años estuvieran protegidas contra el virus de la influenza H1N1 2009, pero los niños generalmente tenían una menor respuesta inicial a la vacuna. Los CDC recomendaron que los niños menores de 10 años recibieran dos dosis de la vacuna contra la influenza H1N1 2009. Los resultados de los ensayos realizados en adultos se publicaron posteriormente en diciembre, y los datos indicaban que la respuesta inmunológica era excelente entre los adultos vacunados. Los datos de seguridad de estos ensayos indicaban que los efectos secundarios de la vacuna eran similares a aquellos observados con las vacunas contra la influenza estacional.
El 30 de septiembre de 2009, los estados pudieron realizar sus primeros pedidos de vacunas contra la influenza H1N1 2009; cuarenta y siete estados realizaron pedidos ese día, y para el 9 de octubre de 2009, todos los estados y el Distrito de Columbia habían realizado pedidos de vacunas. Las primeras dosis se administraron el 5 de octubre de 2009.
Debido a que los suministros iniciales de la vacuna era limitados, la mayoría de los departamentos de salud estatales y locales solicitaron que las vacunas se administraran sólo a aquellas personas en los grupos objetivo iniciales y muchos restringieron el uso a aquellas en grupos de prioridad secundaria que también habían sido detallados por ACIP. Las primeras seis semanas luego de que salieran a la venta las vacunas se caracterizaron por una alta demanda de vacunas y por una disponibilidad limitada. En octubre de 23, el ACIP discutió temas relacionados con las vacunas contra la influenza, entre los que se incluyeron la conveniencia de los grupos objetivo iniciales desarrollada en julio de 2009, y decidió que la guía de julio continuaba siendo adecuada. El ACIP continuó destacando el rol de los encargados de las tomas de decisiones para determinar cuándo comenzar a ofrecer la vacuna a personas que no se encontraban dentro de los grupos objetivo iniciales.
A medida que el suministro de vacunas aumentaba, a fines de noviembre y principios de diciembre, la mayoría de los estados habían comenzado a levantar las restricciones para el uso de la vacuna contra la influenza H1N1 2009, y a fines de diciembre, la vacunación se había abierto a todo aquel que quería vacunarse. También a partir de diciembre de 2009, el Centro del HHS para Asociaciones Religiosas y de los Vecindarios se asoció con las oficinas regionales del HHS con el fin de organizar once teleconferencias para involucrar a la comunidad y las organizaciones religiosas en la respuesta ante la influenza H1N1 2009. Debido a que la mayoría de los estados levantaron las restricciones a la vacunación, estos llamados presentaron una oportunidad para recordar a los socios claves que debían consultar a los departamentos de salud locales para determinar la disponibilidad de la vacuna. Durante la semana del 22 de diciembre, la distribución de la vacuna contra la influenza H1N1 2009 se había abierto a las farmacias minoristas para que pudieran realizar pedidos de vacunas en forma directa, lo que generó la expansión del alcance de la disponibilidad de la vacuna.
En diciembre de 2009, los CDC publicaron en el MMWR resultados de seguridad preliminares sobre las vacunas contra la influenza H1N1 2009 a partir de los informes de los primeros meses recibidos a través del Sistema para Reportar Reacciones Adversas a las Vacunas (VAERS), un sistema de vigilancia nacional de informes voluntarios y datos del proyecto Vaccine Safety Datalink. Los resultados indicaron que la gran mayoría de los eventos adversos (95)%) informados a VAERS luego de la administración de la vacuna contra la influenza H1N1 2009 no eran graves (por ej., dolor en el lugar de la inyección). Del total de 3,783 informes, 204 (5%) fueron informes que se trataban de eventos de salud considerados graves (definidos como aquellos que pueden poner en peligro la vida, o causar la muerte, discapacidad importante, condiciones anormales en el nacimiento, hospitalización o extensión de un hospitalización existente). El porcentaje de informes que trataron sobre eventos de salud considerados graves no eran muy distinto del relacionado con las vacunas contra la influenza estacional y la influenza H1N1 2009.
La vacuna contra la influenza H1N1 2009 se fabricó siguiendo varias fórmulas, utilizando los mismos fabricantes y las mismas prácticas de fabricación utilizadas para producir la vacuna contra la influenza estacional. La máxima prioridad continúa siendo el monitoreo de la seguridad de la vacuna contra la influenza. Los CDC y la Administración de Alimentos y Medicamentos (FDA) trabajaron con otras agencias con el fin de establecer y mejorar los sistemas de vigilancia existentes para detectar rápidamente cualquier evento adverso inesperado entre personas que están vacunadas y para ajustar el programa de vacunación, si fuera necesario, para minimizar los riesgos y maximizar los beneficios de la vacunación. Los dos sistemas importantes utilizados para monitorear la seguridad de la vacuna que han estado en vigencia durante 20 años, son Sistema para Reportar Reacciones Adversas a las Vacunas (VAERS), operado conjuntamente por los CDC y la FDA, y el proyecto Vaccine Safety Datalink (VSD) , un proyecto de colaboración entre los CDC y ocho organizaciones de cuidados de salud administrada, que cubren a más de nueve millones de miembros (aproximadamente 3% de la población de los Estados Unidos). Estos sistemas están diseñados para determinar si están ocurriendo eventos adversos están entre las personas vacunadas a una tasa mayor que la esperada. Los CDC trabajaron con la FDA y otros socios para fortalecer los sistemas de monitoreo de la seguridad de la vacunas y desarrollar nuevas maneras de monitorear la seguridad de la mismas. Además, basándose en la recomendación del Comité Asesor Nacional de Vacunación (NVAC), el HHS estableció el Grupo de trabajo para la evaluación de riesgos de la vacuna contra el H1N1 para reseñar los datos de seguridad de la vacuna contra la influenza H1N1 2009 a medida que se van acumulando. Este grupo de trabajo de expertos externos lleva a cabo revisiones rápidas y regulares de datos disponibles a partir de los sistemas de monitoreo de seguridad federal y los presentará ante la NVAC y las autoridades federales para tomar políticas de acción y seguimientos adecuados.
También en diciembre de 2009, el HHS se unió a Ad Council para lanzar una nueva campaña nacional de anuncios de servicios públicos llamada Juntos podemos combatir la influenza que alentó a los estadounidenses a vacunarse contra la influenza H1N1 2009. La semana del 18 de diciembre de 2009 estuvieron disponibles los primeros 100 millones de dosis de la vacuna contra la influenza H1N1 2009.
El año 2010 comenzó con la Semana Nacional de la Vacunación contra la Influenza (NIVW). La NIVW se celebra a nivel nacional con el fin de destacar la importancia de seguir vacunándose contra la influenza pasada la temporada festiva, durante enero y posteriormente. El Presidente de los Estados Unidos proclamó la semana del 10-16 de enero de 2010, la Semana Nacional de la Vacunación contra la Influenza y alentó a todos los estadounidenses a respetar la semana vacunándose contra la influenza H1N1 2009 y pidiéndoles a sus familiares, amigos y compañeros de trabajo que hagan lo mismo. Los CDC y el HHS, junto a los estados y muchos otros socios públicos y privados, lanzaron una campaña integral de NIVW con el objetivo de concientizar sobre la vacunación, ofrecer oportunidades educativas, recursos gratis, además de clínicas de vacunación. Todos los años, ciertos días durante la NIVW se destinan para destacar la importancia de ciertos grupos; la semana de este año se dedicó a resaltar la importancia de la vacunación del público en general y de los trabajadores del sector de la salud, las personas con enfermedades crónicas que las colocan en alto riesgo de padecer complicaciones graves relacionadas con la influenza, niños, embarazadas y cuidadores de bebés menores de 6 meses , adultos jóvenes de 19 a 24 años y personas de 65 años y mayores. Por ejemplo, los eventos del martes 12 de enero se centraron en las personas con afecciones médicas crónicas que las colocan en mayor riesgo de desarrollar complicaciones graves relacionadas con la influenza. Las actividades nacionales incluyeron un seminario virtual al que asistieron aproximadamente 1,000 participantes. Este esfuerzo conjunto fue organizado por el HHS, los CDC, la Sociedad Americana del Cáncer, la Asociación Estadounidense de Diabetes y la Asociación Americana del Pulmón. Además, la secretaria Sebelius participó en dos teleconferencias donde anunció los nuevos anuncios de servicios públicos (PSA) destinados a las audiencias afroamericanas y de nativos estadounidenses. El director del Servicio de salud para los indígenas se unió a la Secretaria para destacar la importancia y los beneficios de la vacunación.
El 15 de enero de 2010, los CDC publicaron un artículo en el MMWR sobre la cobertura de la vacunación monovalente contra la influenza A (H1N1) 2009 en los Estados Unidos entre octubre y diciembre de 2009. Los resultados del estudio indicaron que los esfuerzos para administrar la vacuna a los grupos objetivo fueron en gran medida exitosos. Con anterioridad, durante el período de 3 meses, el 85% de las vacunas disponible llegó a las personas dentro de las poblaciones objetivo iniciales. A fines de diciembre, gracias a que muchos programas extendían la vacunación a todas las poblaciones, el 74% de todas las vacunas administradas durante el programa había sido administrado a personas de los grupos de prioridad iniciales.
El 18 de febrero de 2010, la Organización Mundial de la Salud (OMS) publicó recomendaciones para la formulación de las vacunas contra los virus de influenza para la próxima temporada en el hemisferio norte (noviembre 2010 – abril 2011). La OMS recomendó una vacuna trivalente (de tres componentes) que incluyera un virus pandémico similar al H1N1 2009. En febrero de 2010, se anunciaron los componentes de la vacuna contra la influenza 2010-2011. La vacuna contra la influenza 2010-2011 protegerá contra un virus similar al H1N1 2009 además del virus de influenza A H3N2 y un virus de influenza B.
Los Estados Unidos experimentaron una segunda ola de actividad de la influenza H1N1 2009 en el otoño y la actividad alcanzó su punto máximo durante la segunda semana de octubre. Luego de eso, la actividad disminuyó rápidamente por debajo de los niveles de referencia en enero, pero persistió varios meses más a niveles más bajos. Sin embargo, en mayo, los niveles de actividad de la influenza en los Estados Unidos fueron bajos para todos los indicadores fundamentales de la influenza. El informe de la temporada de influenza 2009-2010 finalizó el 28 de mayo de 2010. Aunque la actividad de la influenza alcanzó niveles normales durante el verano en los EE. UU., los CDC siguieron recomendando la vacunación contra la influenza, especialmente para las personas en alto riesgo, debido a los informes continuos de casos esporádicos de la influenza H1N1 2009, la propagación de la influenza H1N1 2009 en el hemisferio sur y la posibilidad de que los virus H1N1 2009 podrían circular tempranamente durante la siguiente temporada de influenza.
Actividades de comunicación de los CDC durante la pandemia de influenza H1N1 2009
La respuesta de los CDC ante la pandemia de influenza H1N1 2009 fue dirigida por la ciencia y evolucionó para satisfacer las necesidades del país a medida que se desarrollaban los eventos y se disponía de más información. Sin embargo, una coherente estrategia de comunicaciones subyacente destacó toda la respuesta de los CDC. La estrategia se basa en los principios de comunicación de riesgos durante emergencias sobre la comunicación exacta, rápida, proactiva y transparente para el público y los socios. Esta estrategia incluyó la explicación clara de los objetivos y acciones de los CDC en respuesta a la cambiante situación y el reconocimiento de lo que no se conocía y de lo que se conocía. Otra parte importante de la estrategia fue cuando los CDC crearon la expectativa de que la información y el asesoramiento cambiarían rápidamente a medida que cambiara la situación. Desde los primeros días de la pandemia, los CDC regularmente articularon sus objetivos para «reducir la propagación y la gravedad de la enfermedad y ofrecer información para ayudar a los proveedores de servicios de salud, los funcionarios de salud pública y el público a enfrentar los retos que presentaba el nuevo virus». Durante toda la respuesta y esforzándose para brindar la información más útil de la manera más efectiva, los CDC se basaron en el conocimiento existente y trabajaron con sus socios para realizar una investigación y evaluación científica del conocimiento, las actitudes y las prácticas de las personas relacionadas con distintos temas, inclusive la influenza H1N1 2009, la guía de control del contagio y la vacunación.
La publicación de la información de los CDC y el intercambio de información con sus socios, especialmente durante los primeros días del brote, se llevó a cabo durante un ciclo de 24 horas. Esto incluyó actualizaciones frecuentes a los medios y al público, el uso coordinado de un grupo central de voceros, la información diaria a los socios y el rápido establecimiento y el mantenimiento continuo de un completo sitio web específicamente dedicado a la respuesta ante emergencias ante la influenza H1N1 2009. El objetivo fue no sólo mantener toda la transparencia posible en todas las actividades relacionadas con el manejo de la respuesta de salud pública, sino también mantener la credibilidad y continuar siendo una fuente confiable de información para el público y sus socios.
Al comenzar tempranamente la respuesta y continuar todo el año y en 2010, se prestó especial atención a mantener informados a los socios de salud pública estatales y locales acerca de las actividades de los CDC. Se suministraron regularmente mensajes clave para ayudar a mantener la comunicación coherente y clara durante toda la respuesta. También se prestó especial atención a la recolección frecuente de comentarios de parte de los socios de salud pública locales y estatales para ayudar a asegurar que las recomendaciones de los CDC reflejaran fielmente lo que estaba pasando realmente. Las teleconferencias organizadas frecuentemente con la Asociación de Funcionarios de Salud Estatales y Territoriales, la Asociación Nacional de Funcionarios de Salud de los Condados y las Ciudades y la Coalición Nacional de Información sobre Salud Pública demostraron ser una manera efectiva de compartir información. Además el 24 de abril de 2009, los CDC organizaron la primera de más de 30 teleconferencias organizadas por la Actividad de comunicación y alcance clínico (COCA), que presentaron varios temas relacionados con la influenza H1N1 2009. La COCA fue diseñada para llegar a un grupo variado de proveedores de servicios de salud y ofrecer un sistema a través del cual los médicos clínicos pudieran comunicar sus necesidades educativas a los CDC y recibieran respuestas a sus preguntas sobre enfermedades emergentes relacionadas. En el pico máximo de la respuesta a la influenza H1N1 2009, la COCA tuvo más de 41,100 suscriptores de Listserv.
Los CDC también trabajaron para mantener informada a la comunidad que diseña las políticas. Los CDC brindaron respuestas a las solicitudes del Congreso mediante información y ruedas de prensa sobre temas relacionados con la influenza H1N1 2009, y también ofrecieron actualizaciones de la información por correo electrónico y en su sitio web a medida que se desarrollaba la pandemia. En total, los CDC participaron de 14 audiencias, brindaron asistencia técnica en otras 12 audiencias, publicaron más de tres docenas de boletines informativos sobre la influenza H1N1 2009 para los formuladores de políticas, organizaron más de 40 ruedas de prensa o charlas en el Congreso y respondieron más de 350 preguntas del Congreso sobre la pandemia.
Hubo un esfuerzo coordinado para obtener información a la brevedad posible y mantener al público y a los socios informados de los desarrollos a medida que se presentaban, incluso cuando la guía cambiaba rápidamente. Por ejemplo, cuando se confirmaban en laboratorio relativamente pocos casos de infección humana con este virus y la gravedad de la pandemia no se conocía, el 28 de abril de 2009, los CDC publicaron una guía para las escuelas y aconsejaron su cierre si existía un caso presunto o real con el objetivo de disminuir el riesgo de propagación de la influenza H1N1 2009 en sus comunidades. A medida que hubo más información disponible que sugería un menor riesgo de gravedad de la enfermedad y muerte por influenza H1N1 2009, seis días después se cambió la recomendación y se expresó en contra del cierre de las escuelas con el propósito de mitigar la diseminación del virus en la comunidad.
El desarrollo de la guía de los CDC es un ejemplo de la comunicación en equipo y el intercambio de información que tuvo lugar entre los CDC, el HHS, otras agencias federales y socios externos. El desarrollo de una guía adecuada a menudo se basaba en las comunicaciones de los CDC con muchos socios externos varios días a la semana, con el objetivo de obtener un consenso sobre cuál sería la mejor práctica de acuerdo con los mejores conocimientos actuales disponibles. Por ejemplo, los CDC trabajaron con representantes de un número de organizaciones, que incluyen pero no se limitan al Consejo de Epidemiólogos Estatales y Territoriales (CSTE), Asociación Nacional de Funcionarios de Salud de los Condados y las Ciudades (NAACHO), Academia Estadounidense de Pediatría (AAP), Academia Estadounidense de Médicos de Familia (AAFP), Colegio Estadounidense de Obstetricia y Ginecología (ACOG), Asociación de Funcionarios de Salud Estatales y Territoriales (ASTHO, por sus siglas en inglés), Colegio de Médicos de EE. UU. (ACP), Sociedad Estadounidense de Enfermedades Infecciosas (ISDA), Academia Estadounidense de Pediatría (AAP), Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) y Organización Mundial de la Salud (OMS), durante el desarrollo de la guía relacionada tanto a los sistemas de vigilancia como el uso adecuado de medicamentos antivirales durante la pandemia. Sobre el tema de la vacunación, estas discusiones ayudaron a informar la toma de decisiones del Comité Asesor sobre Prácticas de Inmunización (ACIP).
Aparte de la colaboración en curso entre los CDC y sus socios externos, la respuesta de comunicación para la influenza H1N1 2009 también se caracterizó por una coordinación cerrada y constante entre los comunicadores de los CDC y sus científicos para asegurar que los mensajes fueran científicamente exactos. Además, los comunicadores de los CDC se dedicaron a analizar con regularidad los comentarios de las fuentes externas, incluyendo sondeos y encuestas, para asegurar que los mensajes de los CDC fueran claros.
Los CDC brindaron un flujo constante de información a distintas audiencias: desde el público hasta farmacéuticos, bioquímicos y socios internacionales y países de todo el mundo. La información suministrada por los CDC llegó a miles de audiencias a través de una variedad de canales, incluyendo: una línea directa de información las 24 horas, ruedas de prensas para los medios, la divulgación a través de red de alerta de salud, publicaciones diarias (como podcasts de audio y video) en el sitio web de los CDC sobre la influenza H1N1 2009, actualizaciones habituales en Facebook y Twitter, y la comunicación posterior por parte de las organizaciones socias y los socios a sus propias audiencias, para mencionar sólo algunos canales. Por ejemplo, en noviembre de 2009, los CDC lanzaron una campaña nacional de concientización sobre salud pública para los viajeros y los instó a planificar con anticipación y mantenerse informados sobre qué hacer si se enfermaban cuando estuviesen lejos de sus hogares. La campaña utilizó varios medios, entre los que se incluyeron afiches informativos distribuidos en más de 300 puertos de ingreso en los Estados Unidos, radio nacional y publicidad impresa, medios sociales y líneas directas, que culminó en más de 80 millones de exposiciones. Los CDC también trabajaron coordinadamente con el HHS y el sitio web Flu.gov y publicaron kits de herramientas de comunicación para la temporada de influenza 2009-2010 dirigidos a empresas, empleadores, grupos de cuidado infantil e instituciones de educación superior.
La campaña de vacunación de los CDC contra la influenza estacional y la influenza H1N1 2009 estuvo constituida por múltiples esfuerzos de comunicación, entre los que se incluyeron artículos destinados a numerosas audiencias como padres y adultos jóvenes, en medios de comunicación de alto perfil. Las publicaciones de artículos dieron como resultado casi 403 millones de materiales impresos. Otros esfuerzos de comunicación nacional se hicieron mediante herramientas de medios, avisos en la radio, dos anuncios de servicios públicos en televisión (PSA), banners en línea y publicidad en los autobuses de las ciudades. Se hizo una gran cantidad de material impreso en diferentes idiomas para ser distribuido por los socios y se realizaron miles de descargas del mismo. Las audiencias especiales para quienes se destinó todo este material impreso adicional incluyeron: nativos estadounidenses, afroamericanos, hispanos, embarazadas, adultos jóvenes, personal de emergencias y trabajadores de los cuidados de salud.
Además de los materiales brindados para la campaña de vacunación contra la influenza H1N1 2009 y estacional, los CDC proporcionaron otros materiales claves en varios idiomas. Por ejemplo, el sitio web en inglés sobre influenza H1N1 2009 fue traducido íntegramente al español. Además, las herramientas y recursos clave se tradujeron al chino, vietnamita, coreano, francés, alemán, árabe, ruso, amárico, persa, somalí, karen, birmano, camboyano y kirundi.
En total, entre abril de 2009 cuando surgió la primera influenza H1N1 2009 y abril de 2010, los CDC organizaron 60 eventos para medios (39 ruedas de prensa y 22 ruedas de prensa televisadas) con un total de más de 35,000 participantes. Los CDC también organizaron su primer taller de dos días para los medios sobre temas relacionados con la influenza estacional y la influenza H1N1 2009 a fines de agosto. Aunque en un principio estuvieron pensados para 12 miembros de los medios de prensa, asistieron más de 40 periodistas de medios nacionales, regionales y locales que representaban a la radio, la televisión, los diarios, las revistas y los medios de prensa en línea. Los oradores del evento fueron la Secretaria de Salud y Servicios Humanos, el Director de los CDC, expertos en influenza, expertos en seguridad de las vacunas y expertos en laboratorio. La línea directa de los CDC (1-800-CDC-INFO) respondió más de 211,000 preguntas relacionadas del público en general y de los proveedores de servicios de salud, y el sitio web de los CDC sobre influenza H1N1 2009 tuvo más de 219,595,000 visitas. Además, la cantidad de fanáticos de los CDC en Facebook llegó a más de 55,000 y el perfil de emergencia en Twitter tuvo más de 1,200,000 seguidores.
Fuente: http://espanol.cdc.gov/ Fotos CNN.MX