Denuncian que no hay vacunas para influenza H1N1 en Carabobo
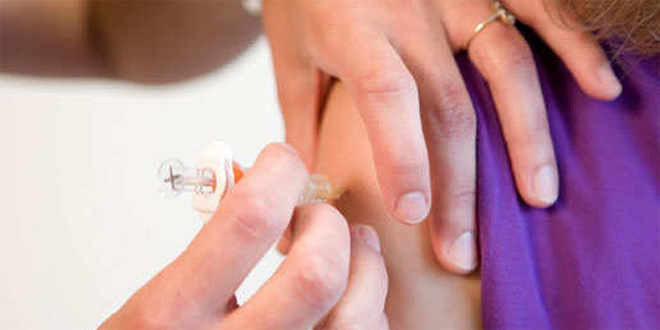
El presidente del Colegio de Enfermeras y Enfermeros de Carabobo, Julio García, indicó que luego de monitorear el proceso de vacunación en la región, a través de los agremiados encargados del manejo y control de las áreas asistenciales se pudo determinar la irregularidad. Dijo que ante la situación que vive Venezuela la dotación de estos […]
CICPC investigará muerte del asesino de mujeres de Petare

El CICPC abrirá una investigación por la muerte del hombre que asesinó a las tres mujeres en el sector las Minas de Guaicoco, Petare, según informó el subdirector de ese cuerpo policial Douglas Rico. «Esta persona fue localizada por una poblada que le causó una serie de lesiones, entre ellas herida con arma blanca […]
Así golpeó a México el brote de influenza AH1N1 en 2009

México vivió en abril de 2009 una de sus más grandes crisis en materia de salud pública debido a la pandemia del virus de la influenza AH1N1 Este documento resume los eventos claves de la pandemia de la influenza H1N1 2009 y las actividades de respuesta de los CDC para fines históricos. Este documento […]
Venezuela quiere mantener cuotas en la OPEP y defiende precio de 100 dólares el barril

El ministro del Petróleo, Rafael Ramírez, aseguró este jueves en Viena que su país defenderá mantener la cuota de producción de 30 millones de barriles al día (mbd) en la reunión de la OPEP, prevista el viernes, y afirmó que su objetivo es mantener un precio mínimo de 100 dólares el barril. «Estamos todos […]
Junta Directiva del CNE debatirá sobre auditoría de no duplicidad y funcionamiento del SAI este jueves

Para este jueves está prevista una sesión de la Junta Directiva del Consejo Nacional Electoral (CNE), en la cual se debatirá un tema pendiente desde la sesión del pasado 8 de mayo y tiene que ver con la auditoría de no duplicidad y el reporte del funcionamiento del SAI. El CNE habría prometido entregar […]
Uribe: Reunión en Bogotá no fue clandestina como la de Venezuela con FARC

El expresidente Álvaro Uribe Vélez defendió la reunión que se dio en el miércoles entre el presidente Juan Manuel Santos y el excandidato presidencial de Venezuela, Henrique Capriles. Según Uribe, la reunión de Santos y Capriles se adelantó totalmente en términos «institucionales» y fue «conocida» por toda la opinión pública. «Reunión del presidente […]
Díaz: Gobierno se escandaliza y olvida reunión en Venezuela con las FARC

El rector del Consejo Nacional Electoral (CNE), Vicente Díaz rechazó que el Gobierno se escandalice por la reunión que sostuvieron el primer mandatario de Colombia, Juan Manuel Santos y el gobernador del estado Miranda y líder de la oposición, Henrique Capriles Radonski en la Casa de Nariño, este jueves. Díaz, por medio de un […]
Exposición “Trazos de la Intuición” será inaugurada en la AF Chacaito

En el mes de junio Gloria Rojas dejará al descuebierto dibujos y grabados en su más reciente trabajo “Trazos de la Intuición”, exposición que permanecerá abierta hasta el 3 de agosto. El jueves 6 de junio se llevará a cabo la inauguración de esta exposición en la Alianza Francesa de Chacaito./YG Fuente:Nota de […]
Comunicado de 6to Poder: Presidente de Conatel al margen de la ley.

El grupo 6to Poder, exhorta al gobierno del Presidente Nicolás Maduro Moros, que responda los comunicados de la Sociedad Interamericana de Prensa (LA SIP), la Asociación Internacional de Radiodifusión (AIR) y el Colegio Nacional de Periodistas, sobre la salida por presiones de funcionarios de Conatel de la señal Atel Televisión. Funcionarios de Conatel, obligaron […]
Eduardo Gómez Sigala: «Este gobierno tiene como política de Estado convivir con la delincuencia»

Más de 20 planes de seguridad, 12 ministros de Interior y de Justicia, decenas de cárceles armadas y el aumento de la criminalidad en Venezuela forma parte del saldo rojo producto de las políticas públicas que ha implementado este gobierno durante14 años, según el diputado por la Alternativa Democrática Eduardo Gómez Sigala, quien aseguró que […]
